企业动态
塔吉瑞全新机制抗慢粒白血病 Bcr-Abl 变构抑制剂 TGRX-678 完成首例受试者给药
2021-05-12 浏览量:
近日,小分子靶向药领军企业深圳市塔吉瑞生物医药有限公司(以下简称“塔吉瑞”)在北京大学人民医院进行 I 期临床试验的全新机制抗慢性髓系白血病( Chronic Myelocytic Leukemia, CML )Bcr-Abl 变构抑制剂 TGRX-678 已成功完成首例受试者给药( FIH )。
慢性髓系白血病,俗称慢粒,是骨髓造血干细胞克隆性增殖形成的恶性肿瘤。在受累的细胞系中,可找到 Ph 染色体和(或)BCR-ABL 融合基因[1]。我国慢性髓系白血病的年发病率为0.39/10万~0.99/10万。调查结果显示,中国慢粒患者中位发病年龄为 45~50 岁,相较西方国家 CML 中位发病年龄 67 岁[2] ,更趋于年轻化。
目前临床上用于慢粒临床治疗的 Bcr-Abl 抑制剂包括,一代伊马替尼、二代尼洛替尼、达沙替尼、博舒替尼、氟马替尼,以及三代帕纳替尼(尚未在国内上市)等。因慢粒起病缓慢,早期常无自觉症状,部分病人在确诊时已处晚期,而晚期患者对药物耐受性差,缓解率低且缓解期很短[1]。2018 年电影 《我不是药神》 的热播,引发社会各界对慢粒与患病群体用药难问题的关注:国内慢粒患者或因无法负担昂贵的进口原研药物价格、对现有药物产生耐药或不耐受等原因,面临着无药可用的困境。
TGRX-678 是由塔吉瑞独立研发,拥有自主知识产权且具有全新药物结构的一类抗肿瘤药物。不同于作用在催化位点的已上市 1~3 代靶向药物, TGRX-678 靶向作用于 BCR-ABL 融合基因的变构位点,可用于治疗对现有药物的耐药(包括守门残基 T315I 突变耐药)或不耐受的 CML 患者。
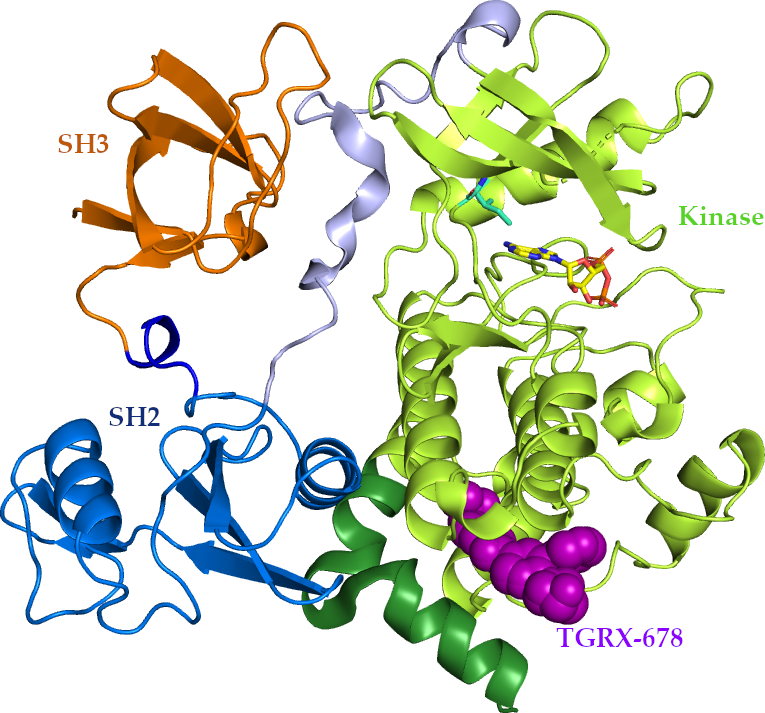
此次在北京大学人民医院进行的 I 期临床试验主要目的是为了探索 TGRX-678 片多次给药在人体内的安全性、耐受性,并确定最大耐受剂量(MTD)以及 II 期研究的推荐给药剂量(RP2D)。
塔吉瑞创始人兼首席执行官王义汉博士有数十年靶向抗癌小分子药物研发的海外从业经历,在药物设计领域有着非常丰富的经验,同时他也是国际上唯一一个获 FDA 批准上市的第三代慢粒一类新药 IClusig® (帕纳替尼,Ponatinib) 的核心发明人。
就此次 TGRX-678 成功完成首例受试者给药,王博士表示:“在 TGRX-678 的结构设计上,我们采用了与前三代药物截然不同的作用位点和机制,具有极佳的选择性。TGRX-678 作为国内首个进入临床试验阶段的全新作用机制 Bcr-Abl 抑制剂,有望把白血病治疗提升到国际先进水平。我们热切期望能够得到一个令人振奋的临床试验结果,让慢粒病人能够用上国际领先且负担得起的国产新药,提高患者们的生活质量,让生命得到保障!目前,TGRX-678 临床患者招募正在积极进行中。
---------------------------------------------相关参考:
[1]葛均波,徐永健,王辰. 《内科学》. 第九版. 北京:人民卫生出版社,2018
[2]中华血液学杂志2020年5月第41卷第5期 《慢性髓性白血病中国诊断与治疗指南(2020年版)》 Chin J Hematol,May 2020,Vol. 41,No. 5







 联系电话:+86-0755-86934300
联系电话:+86-0755-86934300 地址:深圳市南山区科兴科学园 A1 单元 3 楼
地址:深圳市南山区科兴科学园 A1 单元 3 楼 邮箱:
邮箱: