企业动态
2023 ASH | TGRX-678 I 期临床试验及临床前研究结果公布
2023-12-15 浏览量:
深圳市塔吉瑞生物医药有限公司(以下简称“塔吉瑞”)于近日在美国圣地亚哥举行的第 65 届美国血液学会(ASH)年会上,分别以口头报告及壁报展示的形式首次披露了用于治疗慢性髓性白血病(Chronic Myeloid Leukemia, CML)的 BCR-ABL 变构抑制剂 TGRX-678 的Ⅰ期临床试验结果及临床前研究数据。

ASH 2023
December 9-12, 2023, in San Diego
口头报告 (Oral Presentation)

TGRX-678 临床研究主要研究者江倩教授进行口头报告
研究一摘要标题
Safety and Efficacy of TGRX-678, a Potent BCR-ABL Allosteric Inhibitor in Patients with Tyrosine Kinase Inhibitor (TKI) Resistant /Refractory Chronic Myeloid Leukemia (CML): Preliminary Results of Phase I Study
高效 BCR-ABL 变构抑制剂 TGRX-678 治疗酪氨酸激酶抑制剂 (TKI) 耐药/难治性慢性髓性白血病 (CML) 患者的安全性和有效性:I 期研究的初步结果
摘要编号: 185977
演讲者: 江倩教授,北京大学人民医院
报告时间: 2023 年 12 月 11 日 3:15 PM (UTC-8)
分会场: 632. 慢性白血病:临床流行病学:新型治疗方法
核心要点
-
这是一项开放标签的首次人体试验,目的是评估 TGRX-678 在 TKI 耐药或难治性慢性髓性白血病(CML)患者中的安全性、初步疗效和药代动力学特性。该研究包括两个阶段:
1)剂量递增阶段:慢性期或加速期(CP 或AP)既往接受过 ≥3种 TKIs 治疗失败的CML 患者
2)剂量扩展阶段:
- 无 T315I 突变且既往接受过 ≥2 次 TKIs 治疗的 CML-CP ;
- 有 T315I 突变且既往接受过 ≥1 次TKIs 治疗的 CML-CP ;
- 既往接受过 ≥1次TKIs 治疗的 CML-AP 。
-
从 2021 年 4 月 30 日至 2023 年 7 月 11 日,共入组 95 例患者(CML-CP 58例,CML-AP 37例)。入组患者女性占比 42%(40/95),中位年龄 45 岁(范围:35~52),中位既往病程 97 个月(范围:28~136),中位治疗持续时间为 8 个月(范围:6~13)。基线时,98%(93/95)的患者既往接受至少 2 种 TKIs 治疗,其中 82%(78/95)既往接受至少 3 种 TKIs 治疗,46%(44/95)既往接受至少 4 种 TKIs 治疗,48%(46/95) 基线有至少 1 种 ABL 激酶区突变,30%(28/95)有 T315I 突变。
疗效
-
在 58 例 CML-CP患者中,16 例(89%)达完全血液学反应(CHR),25例(43%)达主要细胞遗传学反应(MCyR),19 例(33%)达完全细胞遗传学反应(CCyR),11 例(19%)达主要分子学反应(MMR);
-
在 14 例伴 T315I 突变的CML-CP 中,9 例(100%)达 CHR,9 例(62%)达 MCyR,8 例(57%)达 CCyR,7 例(50%)达 MMR;
-
在 35 例无任何 ABL 激酶区突变的 CML-CP 患者中,12 例(100%)达 CHR,11 例 (31%) 达 MCyR,6 例(17%)达 CCyR,1 例(3%)达 MMR;
-
在 9 例伴其他 ABL 激酶区突变的 CML-CP 患者中,4 例(67%)达 CHR,5 例(56%)达 MCyR,5 例(56%)达 CCyR,3 例(33%)达 MMR;
-
在 37 例 CML-AP 患者中,31 例(84%)达主要血液学反应,13 例(35%)达 MCyR,9 例(24%)达 CCyR;
-
22 例 CML-CP 和 23 例 CML-AP 患者既往接受过第三代 TKIs (Ponatinib 或 HQP1351)或 Asciminib。在 22 例 CML-CP 患者中,21 例(95%)达 CHR,4 例(18%)达 MCyR,3 例(14%)达 CCyR;23 例 CML-AP 患者中,17 例(74%)达CHR,5 例(22%)达 MCyR,3 例(13%)达 CCyR。
安全性
-
研究期间观察到 7 例 DLTs 事件,1例 ALT 升高,为 20mg BID 剂量组;5 例血小板减少,分别为 40mg QD 组1例、40mg BID 组2例、80mg QD 组2例; 1例肝功能异常,为240mg QD。根据方案标准,尚未达到最大耐受剂量(MTD);
-
大多数治疗相关不良事件(TRAEs)为1-2级。发生率大于5%的≥3级 AEs 包括血小板减少(50%)、中性粒细胞减少(42%)、贫血(24%)和高甘油三酯血症(9%)。共15例患者因疾病进展(5例,均为CML-AP)、不耐受(2例)、研究者决定(2例)、撤回知情(6例)等原因终止治疗。研究期间1例患者死亡,与药物无关。
药代动力学特性
PK 结果显示,在 10 mg ~ 80 mg BID 或 40 mg ~ 240 mg QD 范围内,TGRX-678 暴露量(Cmax 和 AUCtau)随剂量增加而呈比例增加。TGRX-678 在人体血浆内消除较慢,半衰期(T1/2)约为 120 小时。稳态下 Cmax 和 AUCtau 的蓄积率分别为 3.7 ~ 8.0 和 5.4 ~ 11.8。TGRX-678 的高蓄积率不仅使得血浆暴露量增加,同时也缩小了谷浓度(Ctrough)和峰浓度(Cmax)间的差值。
结论
TGRX-678 在经治 CML 患者中耐受性良好,并且在所有研究队列中,包括对 T315I 等多种耐药突变的患者,均显示出明显的临床优势,为 CML CP/AP 患者(包括对 Ponatinib 或 Asciminib 治疗失败的患者)提供了一种前景广阔的治疗选择。目前选择了两组剂量来进一步探索 RP2D。其独特的 PK 特性可能会给长期用药的患者带来更多临床获益。
壁报展示(Poster Presentation)
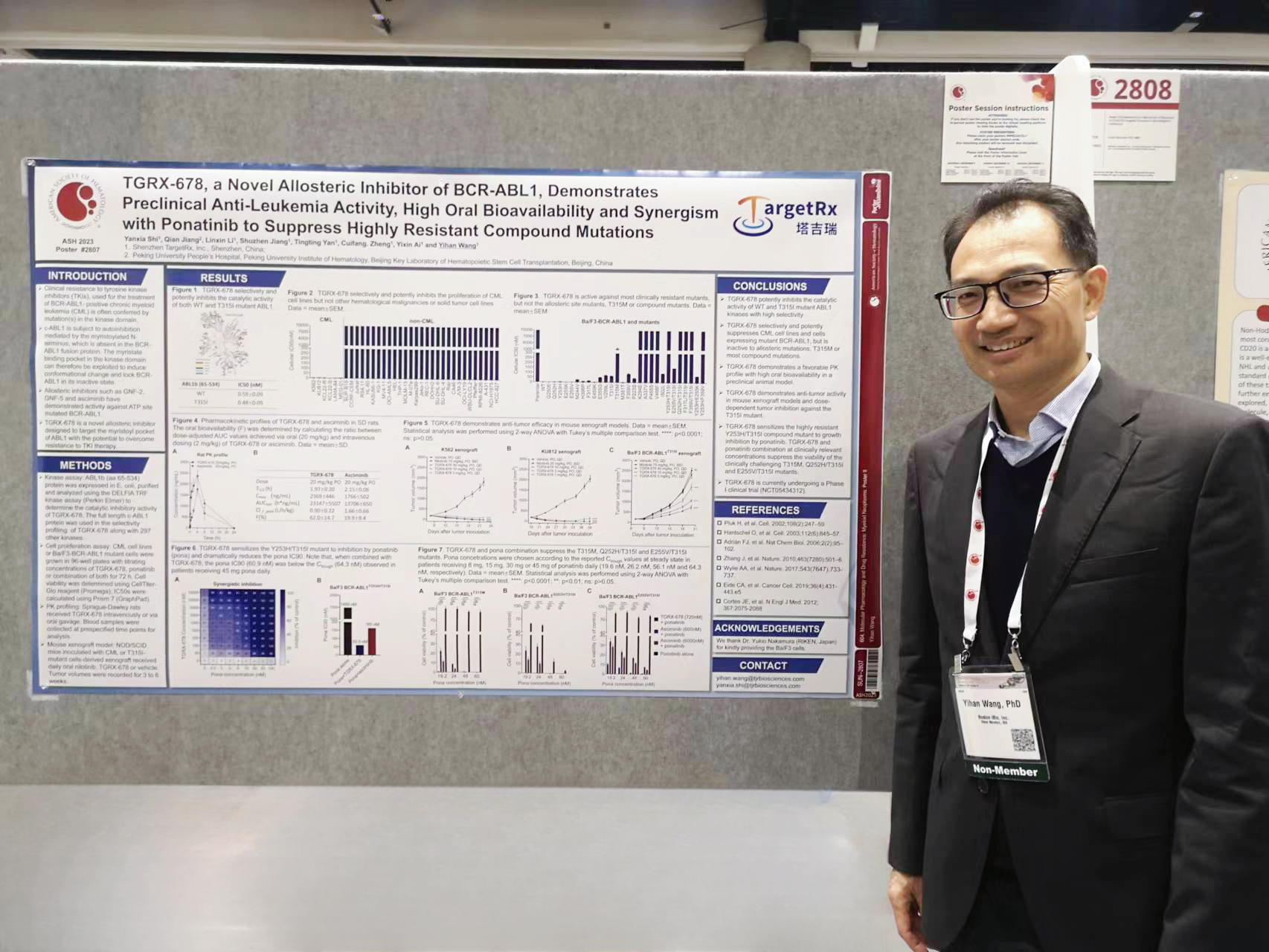
塔吉瑞董事长王义汉博士在现场进行壁板展示
研究二摘要标题
TGRX-678, a Novel Allosteric Inhibitor of BCR-ABL1, Demonstrates Preclinical Anti-Leukemia Activity, High Oral Bioavailability and Synergism with Ponatinib to Suppress Highly Resistant Compound Mutations
TGRX-678, 一种新型 BCR-ABL1 变构抑制剂,展示了临床前的抗白血病活性、高口服生物利用度、与 Ponatinib 联用具有协同效应,以抑制高度耐药的复合突变体
摘要编号: 181391
报告时间: 2023 年 12 月 10 日 6:00 PM - 8:00 PM (UTC-8)
分会场: 604. 分子药理学和耐药:髓系肿瘤:海报 Ⅱ
研究背景
慢性髓性白血病(CML)患者的临床耐药性通常是由 ABL1 激酶结构域的 ATP 结合位点发生突变导致的。变构抑制剂可利用 ABL1 受肉豆蔻酰化触发的构象变化介导的自抑制作用调控来克服抗药性。TGRX-678 是一种针对 ABL1 肉豆蔻酰口袋设计的新型变构抑制剂,目前正在进行 I 期临床试验(NCT05434312)。我们就 TGRX-678 的选择性、药效、抗白血病活性和体内药代动力学(PK)/药效学(PD)等特性进行了研究。
核心要点
-
这是一项关于 TGRX-678 的选择性、药效、抗白血病活性和体内药代动力学(PK)/药效学(PD)特征的临床前研究;
-
TGRX-678 在一组 300 种激酶谱检测中,1 μM 浓度下最大抑制率不到 60%,展现出非常低的脱靶抑制活性,包括自抑制状态的 ABL1 激酶,但对模拟激活状态的野生型ABL1 和 T315I 突变体,IC50 值分别为 0.59 nM 和 0.48 nM;
-
TGRX-678 对几种 CML 细胞系均具有 nmoL 级活性,而对 29 种其他已测人源血液恶性肿瘤和实体瘤的细胞系均无抑制作用。 检测 Ba/F3 BCR-ABL1 WT 或突变细胞系,TGRX-678 对 CML 临床常见突变体具有较强活性,如 G250E(IC50 = 2.49 nM)、Q252H(IC50 = 2.38 nM)、Y253H(IC50 = 5.6 nM)、E255K(IC50 = 1.01 nM)、E255V(IC50 = 2.73 nM)和 T315I(IC50 = 66.1 nM)等;
-
在SD大鼠体内,口服 20 mg/kg的 TGRX-678的 Cmax 为 2369 ng/mL,为 Asciminib 的 1.3 倍。TGRX-678 的总暴露量(AUClast)(23147 h·ng/mL)约为 Asciminib的 1.7 倍。TGRX-678 的口服生物利用度为 62%;
-
在异种移植瘤小鼠 KU812 或 K562 模型中,口服 1 mg/kg QD 或 3 mg/kg QD 的 TGRX-678 分别展示出了对肿瘤生长的完全抑制;
-
在 Ba/F3 BCR-ABL1 T315I 异种移植小鼠中,TGRX-678 呈现剂量依赖性肿瘤消退,45 mg/kg QD 剂量可使肿瘤体积缩小 67% ;
-
TGRX-678 与 Ponatinib 联合几乎完全抑制所测复合突变细胞增殖:
-
尽管单药对 Ba/F3 工程系 Y253H/T315I 突变体均无活性,但 TGRX-678 和 Ponatinib 联合几乎可以完全抑制该细胞增殖。与 TGRX-678 联用,可使 Ponatinib 的 IC90 从临床不可及的 1489nM 降至(60.9nM)临床剂量可及浓度范围内,而 Ponatinib 联用 Asciminib 时,剂量降低指数低于与 TGRX-678 联用,IC90 数据(165 nM)未能降至临床剂量可及的浓度范围;
-
除 Y253H/T315I 复合突变外,还在 E255V/T315I、Q252H/T315I 和 T315M 工程突变细胞中检测了单用 Ponatinib/TGRX-678/Asciminib、比较了不同 Ponatinib 临床剂量下稳态血药浓度附近的点浓度联合抑制活性。结果同样展示了 Ponatinib 联合 TGRX-678 相较于联合 Asciminib 的活性优势。
-
结论
我们的临床前研究结果表明,TGRX-678 具有高度的靶向特异性和活性,对多种 CML 细胞和携带临床 ATP 位点耐药突变的 Ba/F3 工程细胞系有强抑制作用。TGRX-678 具有良好的动物 PK 特性,在动物肿瘤模型中也展现出优异的活性。此外,TGRX-678 和 Ponatinib 联用在 T315M 或 T315I-inclusive 复合突变中的强协同效应为克服当前临床耐药性挑战提供新的可能。以上数据支持我们对 TGRX-678 治疗耐药或难治性 CML 患者进行进一步临床研究。
关于 ASH
2023 年第 65 届美国血液学会年会于 12 月 9-12 日在美国圣地亚哥举行。作为全世界规模最大、权威性最高的血液学学术盛会之一,ASH 年会每年都会汇集各国知名血液病学专家,分享全球最前沿的研究进展和突破性临床研究数据。
关于 TGRX-678
TGRX-678 是由塔吉瑞独立研发,拥有全球自主知识产权且具有全新药物结构的一类治疗慢性髓性白血病(CML)药物。不同于作用在催化位点的已上市 1~3 代靶向药物,TGRX-678 靶向作用于 BCR-ABL 融合基因的变构位点(STAMP),具有治疗对现有上市药物的耐药(包括守门残基 T315I 突变耐药)或不耐受的 CML 患者的潜力,包括为 Ponatinib 和 Asciminib 治疗失败的患者提供一个有前景的治疗选择。TGRX-678 目前在中美同时开展临床研究(NCT05434312)。
关于塔吉瑞
塔吉瑞瞄准临床亟需国际新型小分子靶向抗肿瘤药物研发热点及发展趋势,设计、筛选、评价、优化与研发具有自主知识产权的系列原创的最新一代小分子靶向抗肿瘤药物,致力于挑战癌症的升级版——获得性耐药的医学难题。成立至今,已累计申报包括中国、美国、欧洲、日本等在内的 300 余项专利。







 联系电话:+86-0755-86934300
联系电话:+86-0755-86934300 地址:深圳市南山区科兴科学园 A1 单元 3 楼
地址:深圳市南山区科兴科学园 A1 单元 3 楼 邮箱:
邮箱: