企业动态
塔吉瑞抗慢粒 BCR-ABL 变构抑制剂 TGRX-678 被纳入突破性治疗品种
2023-12-26 浏览量:
近日,塔吉瑞自主研发的用于治疗慢性髓性白血病 (CML) 的全新 BCR-ABL 变构抑制剂 TGRX-678 通过国家药品监督管理局新药审评中心 (NMPA) 公示,正式纳入“突破性治疗品种”(Breakthrough Therapy Designation, BTD)名单。
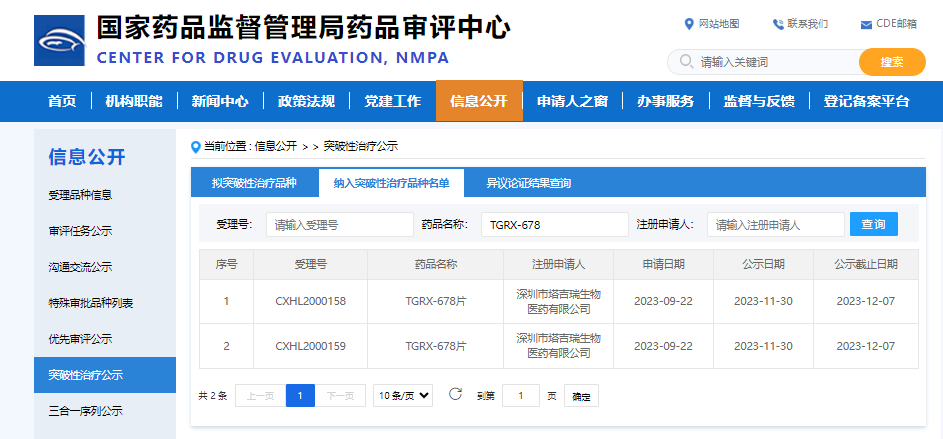
图片来源:国家药品监督管理局药品审评中心官网
CML 是一种以髓系增生为主的造血干细胞恶性疾病。全球年发病率为 (1 ~ 2) / 10 万,占成人白血病总数 15%~20%。酪氨酸激酶抑制剂 (TKI) 伊马替尼 (Imatinib) 的诞生为 CML 治疗带来了除传统造血干细胞移植和放、化疗以外的一种新兴疗法,并将 CML 患者的10年生存率提高到了 83.3 %。二代和三代 TKIs 的陆续上市可以有效针对大部分伊马替尼的抗药性,但部分患者在使用前几代药物后依旧存在药物不耐受或耐药问题。
TGRX-678 是具有全新药物作用机制的一类治疗 CML 药物,由塔吉瑞独立研发。与已获批的 1-3 代 TKIs 药物不同,TGRX-678 靶向作用于 BCR-ABL1 融合基因的变构位点 (STAMP),对现有上市药物的耐药 (包括守门残基 T315I 突变耐药) 或不耐受的 CML 患者具有治疗潜力。
关于突破性治疗
为鼓励研究和创制具有明显临床优势的药物,NMPA 在 2020 年 7 月发布了《药品注册管理办法》(国家市场监督管理总局令第27号)和《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号)。
突破性治疗药物审评程序适用范围为:药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。药审中心(CDE)对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
关于塔吉瑞
塔吉瑞瞄准临床亟需国际新型小分子靶向抗肿瘤药物研发热点及发展趋势,设计、 筛选、评价、优化与研发具有自主知识产权的系列原创的最新一代小分子靶向抗肿瘤药物,致力于挑战癌症的升级版——获得性耐药的医学难题。成立至今,已累计申报包括中国、美国、欧洲、日本等在内的 300 余项专利。
目前,塔吉瑞的两个拳头产品 —— 最新一代治疗慢粒白血病(CML)的全新机制药物 TGRX-678 及治疗非小细胞肺癌(NSCLC)的国际领先第三代 ALK 抑制剂 TGRX-326 正在全国多地开展临床研究,其他创新靶向药产品线也在积极推进中。







 联系电话:+86-0755-86934300
联系电话:+86-0755-86934300 地址:深圳市南山区科兴科学园 A1 单元 3 楼
地址:深圳市南山区科兴科学园 A1 单元 3 楼 邮箱:
邮箱: